DICLOFENAC


Benzoquinona-imina
O diclofenac, ao inibir a produção destes compostos, pode produzir danos na mucosa gástrica, o que pode resultar em hemorragias, ulceração e perfuração gastrointestinais
COX-2
COX-1
Prostanóides
Protegem a mucosa gástrica
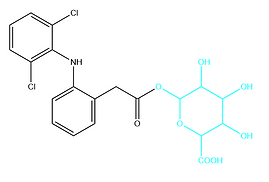
O diclofenac sofre extenso metabolismo hepático, o que pode desempenhar um papel importante na formação de metabolitos reativos, associados com hepatotoxicidade. O mecanismo por detrás da formação de metabolitos reativos do diclofenac envolve a formação de dois metabolitos hidroxilados, 4-OH-diclofenac e 5-OH-diclofenac, envolvidos na formação de metabolitos reativos. A conjugação com o ácido glucurónico envolve o ataque nucleofílico pelo oxigénio rico em eletrões na posição C1 do ácido glucurónico.
Apesar de normalmente benéfica, a conjugação com o ácido glucurónico pode ser uma causa de toxicidade. Os grupos ácido carboxílico podem ser conjugados com o ácido glucurónico para dar acil-glucuronidos. Com alguns AINES, como no caso do diclofenac, o acil glucuronido é reativo e liga-se covalentemente a proteínas. Os conjugados de proteína resultantes podem ser responsáveis por reações imunes como hepatite imune.
TOXICIDADE GASTROINTESTINAL [1] [2]
TOXICIDADE HEPÁTICA [3] [4] [5] [6]
TOXICIDADE RENAL
TOXICIDADE CARDIOVASCULAR
A formação de aductos de proteína é também evidente após metabolismo oxidativo pelas CYP. Foi proposto que, por oxidação dos metabolitos hidroxilados, se formam quinona-iminas como intermediários reativos, que por sua vez reagem com a glutationa. Quando se esgotam as reservas de glutationa, as benzoquinonaiminas conjugam-se com proteínas e outros constituintes celulares, levando a necrose celular.
Assim, o acil glucuronido e as benzoquinona-iminas formadas modificam covalentemente as proteínas, produzindo toxicidade quer por via direta, destruindo funções celulares críticas quer por ação indireta, por estimulação de respostas imunológicas.
Proteínas

Proteína acilada
Acilglucuronido
Toxicidade hepática/hepatite imune
Os efeitos do diclofenac e da maioria dos AINES no sistema cardiovascular são mediados por dois produtos da COX: tromboxano A2, um vasoconstritor e potente estimulador da agregação plaquetária modulado pela isoforma COX-1 e a prostaglandina I2 (PGI2), um vasodilatador potente, inibidor da agregação plaquetária, regulado pela COX-2. O tromboxano A2 aumenta a retenção de fluidos, aumenta a pressão arterial e aumenta o remodelling cardiovascular, enquanto a PGI2 facilita a excreção de fluidos e diminui a pressão arterial. Os AINES afetam o equilíbrio TXA2/PGI2, aumentando o risco de eventos cardiovasculares. [7]
Assim, durante o tratamento prolongado com diclofenac reomenda-se proceder à monitorização hematológica. [2]
Um estudo recente publicado no British Medical Journal revela que a toma de diclofenac, tanto por períodos curtos como períodos longos, aumenta consideravelmente a probabilidade de ocorrência de enfarte do miocárdio e paragem cardíaca. No entanto, os mecanismos subjacentes a este efeito ainda não estão totalmente esclarecidos. [8]
As duas isoformas da ciclooxigenase (COX) estão presentes no rim e os seus metabolitos estão envolvidos na regulação dos fluidos e da pressão sanguínea. [1] A inibição das COX pelo diclofenac, tal como pela maioria dos AINE não seletivos, pode resultar em disfunção renal aguda, síndrome nefrótico, nefrite intersticial e necrose papilar renal. Para além disso, por bloquear os efeitos homeostáticos das prostaglandinas e o equilíbrio eletrolítico, este fármaco pode alterar o controlo da pressão arterial. [9]
No geral, e em indivíduos que possuam função renal normal, o diclofenac apresenta baixo risco de originar condições renais agudas ou crónicas. No entanto, em indíviduos com função renal comprometida e na população idosa o risco é maior, sobretudo quando utilizado em doses elevadas.
Assim, nos doentes submetidos a tratamento durante períodos prolongados é conveniente controlar a função renal como medida de precaução. [2]
As enzimas COX-1 e COX-2 estão envolvidas na produção de prostanoides associadas com proteção gástrica – tanto a 1 como a 2 estão presentes na mucosa gástrica. O diclofenac é um inibidor da COX não seletivo, inibindo por isso a produção de prostanoides protetores gástricos, o que pode conduzir a hemorragias, ulceração e perfuração gastrointestinais potencialmente fatais.






4-hidroxidiclofenac
5-hidroxidiclofenac
Benzoquinona-imina
Conjugação com a glutationa
Depleção de glutationa - conjugação com proteínas e outros constituintes celulares
Referências Bibliográficas
[1] Mitchell, J. A., Warner, T. D. (2006), COX isoforms in the cardiovascular system: understanding the activities of non-steroidal anti-inflammatory drugs. Nature Reviews, 5:75-86.
[2]Infomed - Resumo das características do medicamento Diclofenac labesfal comprimidos gastrorresistentes. Disponível em: http://app7.infarmed.pt/infomed/download_ficheiro.php?med_id=10811&tipo_doc=rcm (acedido a 15/04/2017)
[3] Tang, W. (2003), The metabolism of diclofenac – enzymology and toxicology perspectives. Current Drug Metabolism, 4:319-329.
[4] Timbrell, J. A (2008), Principles of biochemical toxicology, 4th edition, CRC Press
[5] Madsen, K. et al (2008), Bioactivation of diclofenac in vitro and in vivo: correlation to eletrochemical studies. Chem. Res. Toxicol, 21:1107-1119.
[6] Casarett and Doull's Toxicology - The basic Science of poisons. 8th edition
[7] Al-Saeed, A. (2011), Gastrointestinal and Cardiovascular Risk of Nonsteroidal Anti-inflammatory Drugs. Oman Medical Journal, 26 (6):385-391)
[8]Bally, M. et al (2017), Risk of acute myocardial infarction with NSAIDs in real world use: bayesian meta-analysis of individual patient data. British Medical Journal, 357:j1909.
[9] Murray, M. D., Brater, D. C. (1993), Renal toxicity of the nonsteroidal anti-inflammatory drugs. Annu.Rev.Pharmacol.Toxicol., 32:435-65.